B E L A J A R B E R S A M A PAK G I E
Menurut Teori Mekanika Kuantum atau Mekanika Gelombang, keberadaan elektron dalam atom ditentukan oleh 4 bilangan Kuantum
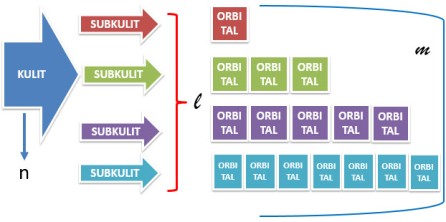
Bilangan kuantum Utama (n)
Bilangan ini menyatakan nomor Kulit Atom yang ditempati elektron ( n=1 kulit K,n=2 kulit L, n=3 kulit M dst )
Bilangan Kuantum azimuth (l)
Bilangan ini menyatakan subkulit yang ditempati elektron.
Setiap kulit terdiri dari sub-sub kulit, jika l=0 untuk subkulit s, jika l=1 untuk subkult p, jika l=2 untuk subkuli d dan jika l=3 untuk subkulit f
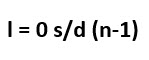
Jadi :
Kulit K (n=1) > subkulitnya adalah subkulit s ( karena l =0)
Kulit L (n=2) > subkulitnya adalah subkulit s dan p ( karena l= 0 dan l=1)
Kulit M (n=3) > subkulitnya adalah subkulit s, p, dan d (karena l=0, l=1, dan l=2)
Kulit N (n=4) > subkulitnya adalah subkulit s, p, d, dan f (karena l=0,l=1, l=2, dan l=3)
Kulit O > subkulitnya adalah s,p,d, dan f
Kulit P > subkulitnya adalah s,p,d
Kulit Q > subkulitnya adalah s, dan p

Bilangan kuantum magnetik (m)
Bilangan ini menyatakan nomor orbital yang ditempati elektron.
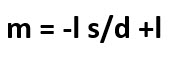
Setiap subkulit terdiri dari orbital-orbital
Jadi
Subkulit s terdiri dari 1 orbital s ( karena l = 0, maka m = 0 artinya ada 1 orbital)
Subkulit p terdiri dari 3 orbital p (karena l = 1, maka m = -1, 0, +1 artinya ada 3 orbital )
Subkulit d terdiri dari 5 orbital d (karena l=2, maka m= -2, -1, 0, +1, +2 artinya ada 5 orbital )
Subkulit f terdiri dari 7 orbital f (karena l=3, maka m= -3, -2, -1, 0, +1, +2, +3 artinya ada 7 orbital )
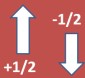
Bilangan kuantum spin(s)
Bilangan ini menyatakan arah rotasi atau perputaran elektron
Tiap orbital berisi sepasang elektron dengan spin atau arah yang berlawanan
Jadi dalam :
Subkulit s terdapat 1 orbital s, berisi maksimum 2 elektron
Subkulit p terdapat 3 orbital p, berisi maksimim 6 elektron
Subkulit d terdapat 5 orbital d, berisi maksimum 10 elektron
Subkulit f terdapat 7 orbital f, berisi maksimum 14 elektron
Banyaknya elektron maksimum dalam orbital ditulis sbb:
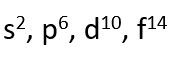
PENYUSUNAN ELEKTRON MENURUT TEORI MEKANIKA KUANTUM
Elektron dalam atom disusun berdasarkan konfigurasi elektron per subkulit (berdasarkan tingkat energi).
Aturan Aufbau
Penyusunan elektron persubkulit dilakukan dengan menggunakan Aturan Aufbau,
Elektron-elektron mengisi orbital dari tingkat energi terendah, kemudian mengisi tingkat energi yang lebih tinggi.
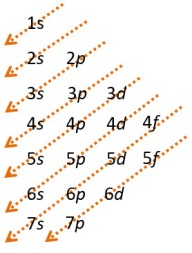
Urutan pengisian elektronnya sebagai berikut
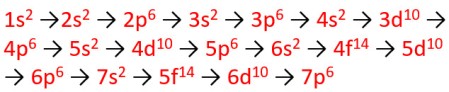
Contoh:
Penulisan konfigurasi elektron dari 16S (berdasarkan tingkat energi).
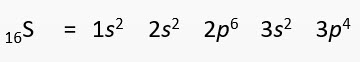
Kaidah Hund
Pengisian elektron dalam orbital dilakukan dengan menggunakan Kaidah Hund
Elektron-elektron tidak membentuk pasangan elektron sebelum masing-masing orbital terisi sebuah elektron.
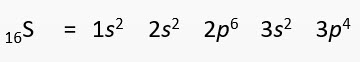
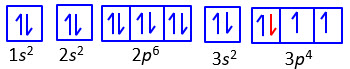
Larangan Pauli :
Tidak diperbolehkan di dalam atom terdapat elektron yang mempunyai keempat bilangan kuantum yang sama.
Contoh :
Bilangan kuantum elektron ke-16 dari atom 16S adalah sebagai berikut :
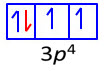
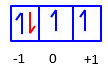
Bilangan kuantum utama = n = 3 (Kulit M)
Bilangan kuantum azimut= l = 1 (Subkulit p)
Bilangan kuantum magnetik = m = -1
Bilangan kuantum spin = -1/2
Coba tentukan bilangan kuantum elektron yang ke -8 dari atom 16S !
Download File PDF> Klik di sini ya











